下列有关电解质溶液中微粒的物质的量浓度的关系正确的是
| A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)> c(OH-)>c(H+) |
| B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C.已知Ka(HF) =7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.浓度均为0.1 mol/L的三种溶液中:①(NH4)2CO3、②(NH4)2SO4、 ③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
下列化学式既能表示物质的组成,又能表示物质的一个分子的是()
| A.NaOH | B.SiO2 | C.Fe | D.CO2 |
a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是





 ()
()

A.常温下,a能从水中置换出氢,而b不能 |
B.原子的电子层数a比b多 |
C.原子的最外层电子数a比b少 |
D.1 mol a 、b分别与足量盐酸反应,生成H2的质量a比b大 |
不能用来区别甲烷和乙烯的是()
| A.酸性高锰酸钾溶液 | B.溴水 |
C.溴的四氯化碳溶液 | D.H2 |
在密闭容器中进行反应2SO2 + O2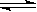 2SO3,反应达平衡的标志是()
2SO3,反应达平衡的标志是()
 ①单位时间内消耗2 mol SO2 的同时生成2 mol SO3
①单位时间内消耗2 mol SO2 的同时生成2 mol SO3 ②反应混合物中,SO2、O2 与SO3 的物质的量之比为2∶1∶2
②反应混合物中,SO2、O2 与SO3 的物质的量之比为2∶1∶2 ③反应混合物中,SO3的质量分数不再改变
③反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ |
C.只有③ | D.只有① |
下列化学用语正确的 是()
是()
A.硫原子的原子结构示意图: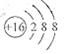 |
B.CH4分子的比例模型: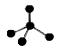 |
| C.乙烯的结构简式:CH2CH2 | D.原子核内有10个中子的氧原子: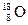 |