室温时,盐酸和硫酸的混合溶液20 ml,向混合溶液中逐滴加入0.05 mol/LBa(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
| A.图中A点对应溶液的pHa=l |
| B.生成沉淀的最大质量m="2.33" g |
| C.原混合溶液中盐酸物质的量浓度为0.1 mol/L |
| D.当V [Ba(OH) 2 (aq)] ="10" mL时,发生反应的离子方程式为:Ba2++SO42-=BaSO4↓ |
对物质进行分类是化学学习中的常用方法。下列物质中属于酸的是
| A.CO | B.NaOH | C.HNO3 | D.CuSO4 |
下列物质中,其产量可以用来衡量一个国家石油化工发展水平的是
| A.甲烷 | B.乙烯 | C.苯 | D.乙醇 |
下列说法正确的是
| A.金属氧化物一定是碱性氧化物 |
| B.碱性氧化物一定是金属氧化物 |
| C.非金属氧化物一定是酸性氧化物 |
| D.酸性氧化物一定是非金属氧化物 |
滴加新制氯水后,下列各组离子可能大量存在的是
| A.Fe3+、Al3+、Cl-、NO3- | B.K+、Na+、I-、SO42- |
| C.Ag+、Ca2+、NH4+、NO3- | D.Na+、Ba2+、CO32-、SO42- |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是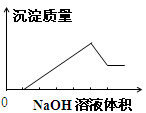
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |