现有X、Y、Z、W、Q五种短周期元素,其原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色。下列有关推断正确的是
| A.W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1∶2 |
| B.简单离子半径:Y>Z>W>Q>X |
| C.X能分别与Y、Z、Q形成共价化合物 |
| D.Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少为3.2g |
| B.0.5L1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA |
| C.Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
| D.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
化学与生活密切相关。下列说法不正确的是
| A.用含增塑剂的聚氯乙烯薄膜作食品包装材料 |
| B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| C.次氯酸钠溶液可用于环境的消毒杀菌 |
| D.中国古代用明矾溶液的酸性清洗铜镜表面的铜锈 |
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
| A.反应在前50s的平均速率v(PCl3)=0.0032mol•L-1•s-1 |
| B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆) |
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中不正确的是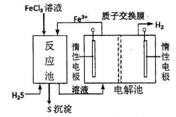
| A.左槽中发生的反应是:2Cl--2e-=Cl2↑ |
| B.右槽中的反应式:2H++2 e-=H2↑ |
| C.H+从电解池左槽迁移到右槽 |
| D.FeCl3溶液可以循环利用 |
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和。下列叙述一定正确的是
| A.氢化物的沸点Y>R>X |
| B.含氧酸酸性R>X |
| C.X、Y不可能共存于离子化合物中 |
| D.原子半径Z>R>Y>X |