下列现象与胶体的性质无关的是
| A.江河的入海口易形成沙洲 |
| B.水泥厂、冶金厂常用高压电进行除尘 |
| C.医院里对肾衰患者进行血液透析 |
| D.氯化钠溶液中加入硝酸银溶液产生白色沉淀 |
下列关于铜电极的叙述正确的是
| A.铜铁作电极的原电池中铜是正极 |
| B.用电解法精炼粗铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为
| A.3.36L | B.4.48L | C.5.6L | D.6.72L |
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿的空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X.这四种金属的活动性顺序是
| A.Y>Z>W>X | B.Z>Y>W>X | C.W>Z>Y>X | D.X>Y>Z>W |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl—2e-=Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
如图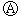 为直流电源,
为直流电源,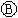 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,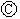 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现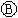 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通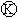 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是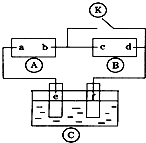
| A.a为直流电源的负极 | B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生还原反应 |