重水(2H2O)是重要的核工业原料,下列说法不正确的是
A.HClO的电子式: 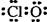  |
| B.11H与21H是不同的核素 |
| C.1H2O与2H2O是同一种物质 |
D.离子结构示意图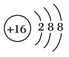 可以表示32S2—,又可以表示34S2— 可以表示32S2—,又可以表示34S2— |
(2014届北京市顺义区高三第一次统练考试化学试卷)
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
(届北京市顺义区高三第一次统练考试化学试卷)
常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴 定曲线如图。下列说法不正确的是
| A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-) |
| B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+) |
| D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-) |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)=c(CHCOO-)+c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
(届广东省深圳市高三一模考试理综化学试卷)
下列表达不正确的是
| A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS- =H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c (CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
(2014届山东省潍坊高密市高三4月月考理综化学试卷)
下列解释实验事实的平衡不正确的是
| 实验 |
解释 |
|
| A |
100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 |
H2O H+ + OH- H+ + OH- |
| B |
0.1 mol/L CH3COOH的pH=3 |
CH3COOH CH3COO- + H+ CH3COO- + H+ |
| C |
配制FeCl3溶液时加少量盐酸 |
Fe3+ + 3OH- Fe(OH)3 Fe(OH)3 |
| D |
用稀硫酸洗涤BaSO4,沉淀损失小 |
BaSO4(s)  Ba2+(aq) + SO42-(aq) Ba2+(aq) + SO42-(aq) |