(15分)氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)左装置图中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是:关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见 。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是 。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是 。
【方案3】按下图步骤测定样品中AlN的纯度:
(6)AlN的质量分数计算的表达式是 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: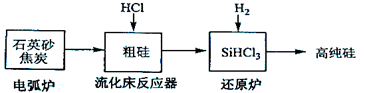
| 发生的主要反应 |
|
| 电弧炉 |
SiO2+2C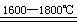 Si+2CO↑ Si+2CO↑ |
| 流化床反应器 |
Si+3HCl SiHCl3+H2 SiHCl3+H2 |
| 还原炉 |
SiHCl3+H2 Si+3HCl Si+3HCl |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
实验室以含有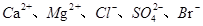 等离子的卤水为主要原料制备无水
等离子的卤水为主要原料制备无水 和
和 ,流程如下:
,流程如下: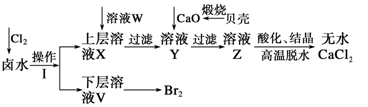
(1)操作Ⅰ使用的试剂是 ,所用主要仪器的名称是 。
(2)加入溶液W的目的是 。用CaO调节溶液Y的pH,可以除去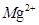 。由表中数据可知,理论上可选择pH最大范围是 。酸化溶液Z时,使用的试剂为 。
。由表中数据可知,理论上可选择pH最大范围是 。酸化溶液Z时,使用的试剂为 。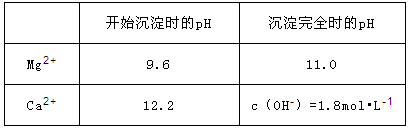
(3)实验室用贝壳与稀盐酸反应制备并收集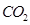 气体,下列装置中合理的是 。
气体,下列装置中合理的是 。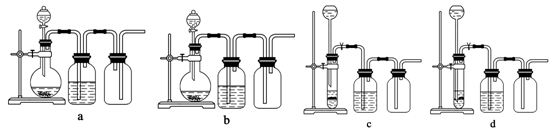
(4)常温下,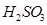 的电离常数
的电离常数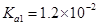 ,
,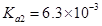 ,
,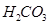 的电离常数
的电离常数 ,
, 。某同学设计实验验证
。某同学设计实验验证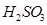 酸性强于
酸性强于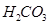 :将
:将 和
和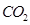 气体分别通入水中至饱和,立即用酸度计测两溶液的
气体分别通入水中至饱和,立即用酸度计测两溶液的 ,若前者的
,若前者的 小于后者,则
小于后者,则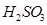 酸性强于
酸性强于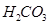 。该实验设计不正确,错误在于 。
。该实验设计不正确,错误在于 。
设计合理实验验证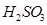 酸性强于
酸性强于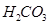 (简要说明实验步骤、现象和结论)。 。仪器器自选。
(简要说明实验步骤、现象和结论)。 。仪器器自选。
供选的试剂: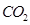 、
、 、
、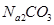 、
、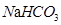 、
、 、
、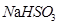 、蒸馏水、饱和石灰水、酸性
、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、
溶液、品红溶液、 试纸。
试纸。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.
已知:氧化性:IO3﹣>Fe3+>I2;
还原性:S2O32﹣>I﹣3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式: .将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+ .
氯碱工业中电解饱和食盐水的原理示意图如图所示
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的 、
、 ,NH+3,
,NH+3, ,[
,[ >
> ]。
]。
精致流程如下(淡盐水和溶液A来电解池):
①泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 ;
③ 的溶解度比
的溶解度比 的小,过程Ⅱ中除去的离子有 ;
的小,过程Ⅱ中除去的离子有 ;
④经过程Ⅲ处理,要求盐水中c 中剩余 的含量小于5mg /l ,若盐水b中
的含量小于5mg /l ,若盐水b中 的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%
的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%  溶液 kg(溶液体积变化忽略不计)。
溶液 kg(溶液体积变化忽略不计)。
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)=1.1 ×10-10 Ksp(BaCO3)=5.1 ×10-9】
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有_________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍