N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/(mol·L-1) |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数K1=125(mol·L-1)3,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的 ,则再次平衡时c(N2O5)>5.00mol·L-1
,则再次平衡时c(N2O5)>5.00mol·L-1
下列有关物质的性质与应用均正确的是
| A.常温下Cl2能与强碱溶液反应,工业生产和实验室可用澄清石灰水吸收氯气尾气 |
| B.苯酚遇FeCl3溶液显紫色,可用FeCl3溶液检验工业生产的废水中是否存在苯酚 |
| C.铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D.碳酸钠溶液与硫酸钙能发生复分解反应,可用硫酸钠溶液清除锅炉水垢中的碳酸钙 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使紫色石蕊试液变红的溶液:NH4+、Al3+、SO42-、Br- |
| B.明矾溶液:K+、C1-、S2-、OH- |
| C.pH=1的溶液:Ag(NH3)2+、Fe3+、ClO4-、NO3- |
| D.能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、SO42- |
下列有关化学用语表示不正确的是
A.氯离子的结构示意图: |
B.K2O的电子式: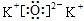 |
C.CO2分子的结构式: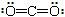 |
D.苯分子的比例模型: |
化学与资源利用、节能减排、环境保护密切相关。下列措施不利于节能减排、环境保护的是
| A.开发利用太阳能、风能等清洁能源 | B.将秸秆粉碎后还田以提高肥效 |
| C.大量使用农药、化肥提高农作物产量 | D.用脱硫处理的煤代替原煤作燃料 |
向甲、乙、丙三个密闭容器中充人一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示()
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5L |
0.5L |
1. 0L |
| 温度/ |
T1 |
T2 |
T3 |
| 反应物 起始量 |
0.5molA 1.5 molB |
0.5 molA 1.5 molB |
2.0 molA 6.0 molB |

下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%