下列有关说法中,不正确的是:
| A.a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| B.常温下,CH3COONa溶液的pH=8,则c(Na+) -c(CH3COO-)=9.9×10-7mol/L |
| C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+) =1×10-8,则溶液中由水电离出的c(H+) =1×10-11mol/L |
| D.在0.1 mol/L Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
下列各组中,属于同位素的是()
A.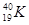 和 和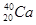 |
B.金刚石和石墨 | C.H2O和D2O | D.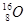 、 、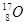 和 和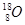 |
利用蛋白质的变性可以为我们的日常生活,医疗卫生服务。下列实例利用了蛋白质的变性的是:①利用过氧乙酸对环境、物品进行消毒;②利用高温、紫外线对医疗器械进行消毒;③蒸煮鸡蛋食用;④松花蛋的腌制;⑤用鸡蛋清灌服重金属中毒的病人。()
| A.全部 | B.①②③④ | C.①②③ | D.①② |
下列物质能够发生水解,且水解产物只有一种的是()
| A.油脂 | B.蔗糖 | C.麦芽糖 | D.天然蛋白质 |
下列各组物质中互为同分异构体的是()
| A.葡萄糖和蔗糖 | B.蔗糖和麦芽糖 | C.乙酸乙酯和乙酸 | D.淀粉、纤维素 |
青苹果汁遇碘溶液显蓝色,熟苹果汁能还原银氨溶液,这说明()
| A.青苹果中只含淀粉不含糖类 | B.熟苹果中只含糖类不含淀粉 |
| C.苹果转熟时淀粉水解为单糖 | D.苹果转熟时单糖聚合成淀粉 |