镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,
其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O ="=" Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
醛可以发生分子间反应,生成羟基醛。如: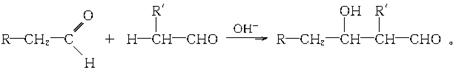 烯烃分子则在一定条件下会发生二分子聚合。如: CH2—CH==CH2
烯烃分子则在一定条件下会发生二分子聚合。如: CH2—CH==CH2
 。
。
(1)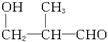 可由_________与______________两种醛合成。(填结构简式)
可由_________与______________两种醛合成。(填结构简式)
(2) 转变为
转变为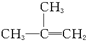 须依次经过__________、__________和_____________等较合理的反应过程。(填反应类型)
须依次经过__________、__________和_____________等较合理的反应过程。(填反应类型)
(3)将 经两分子聚合后的生成物与氢气加成,所得产物按系统命名法称作__________________。
经两分子聚合后的生成物与氢气加成,所得产物按系统命名法称作__________________。
某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请完成下列问题:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是______________________________。
(3)该化合物的化学式(分子式)是________________________________________。
(4)该化合物分子中最多含__________个 官能团。
官能团。
有机物A为茉莉香型香料。
(1)A分子中含氧官能团的名称是__________________________________________________。
(2)C的分子结构可表示为(其中R和R′代表不同的烃基):
A的分子式是____________,A可以发生的反应是____________(填写序号字母)。
a.还原反应b.消去反应c.酯化反应d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________。
(4)A分子结构中只有1个甲基,A的结构简式是____________________________________。
(5)在浓硫酸存在下,B与乙醛共热生成化合物C16H22O2的化学方程式是________________________________________________。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有____________种。
已知柠檬醛的结构简式如下: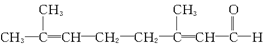
(1)检验柠檬醛分子中含有醛基的方法是________________________________________。
(2)已知溴水可氧化醛基,若要检验柠檬醛分子中含碳碳双键的方法是__________________。
有两种有机化合物A和B,分子式分别为C2H6O和C2H4O,已知:
①B氧化得C,还原得A;
②A能脱水生成烯烃F;
③F能跟溴水反应得D;
④D与氢氧化钠水溶液反应,得到溶于水的产物E。
(1)写出A和B的结构式。
(2)写出上述①至④各反应的化学方程式,并对E命名。