下列各组离子能大量共存于同一溶液中, 且加入过量NaOH溶液或少量稀H2SO4时, 都能产生白色沉淀的是
| A.Ba2+、Mg2+、NO3-、CO32+ | B.Na+、Al3+、Cl-、Mg2+ |
| C.K+、Ba2+、Cl-、HCO3- | D.NH4+、Ba2+、Fe3+、Cl- |
从樟科植物枝叶提取的精油中含有甲、乙两种成分:
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基 b.能与Br2的CCl4溶液发生加成反应 c.遇FeCl3溶液显呈现紫色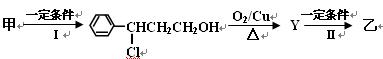
(2) 由甲转化为乙的过程为(已略去无关产物):反应I的反应类型为,反应II的反应类型为_____________,Y的结构简式。
(3) 1mol乙最多可与 molH2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式。
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式如图所示: 
(1)用没食子酸制造墨水主要利用了_____________类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸正丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为_______________
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为_________________,其苯环只与—OH和—COOR两类取代基直接相连且两个取代基位于苯环对位的同分异构体有__________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式: _____
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是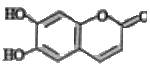
| A.M既能与H2发生加成反应又能使酸性KMnO4溶液褪色 |
B.1 mol M最多能与2mol  发生反应 发生反应 |
C.M与足量的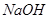 溶液发生反应时,所得有机产物的化学式为 溶液发生反应时,所得有机产物的化学式为 |
D.M既能与FeCl3溶液发生显色反应又能与 反应放出 反应放出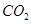 |
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为 
下列说法正确的是
| A. | 可用酸性KMnO 4溶液检测上述反应是否有阿魏酸生成 |
| B. |
香兰素、阿魏酸均可与Na
2CO
3、
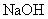 溶液反应 溶液反应
|
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在同一个平面上的是