亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: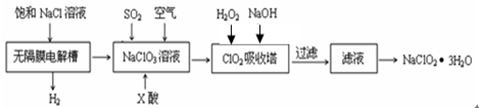
(1)反应生成ClO2气体需要X酸酸化,X酸可以为 。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为 。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。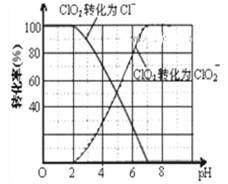
写出pH≤2时ClO2与S2-反应的离子方程式_______ 。
(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式___________________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)
2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图: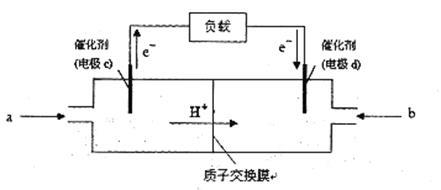
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
食品安全一直是社会关注的话题.过氧化苯甲酰(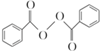 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: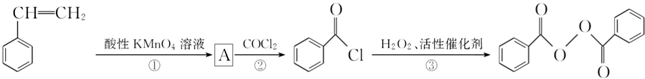 苯乙烯
苯乙烯
请回答下列问题:
(1)写出反应③的化学方程式:___________;过氧化苯甲酰在酸性条件下水解的化学方程式为________;
(2)下列有关苯乙烯的说法正确的是__________(填字母序号);
a.苯乙烯能使溴水褪色
b.苯乙烯存在一种同分异构体,其一氯代物仅有一种
c.苯乙烯分子中8个碳原子可能共平面
d.苯乙烯、庚烷燃烧耗氧量肯定相等
(3)苯甲酰氯(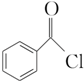 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
(4)写出一个符合下列要求的过氧化苯甲酰的同分异构体的结构简式________________;
①分子中不含碳碳双键或叁键;②分子中只含有一种含氧官能团;③核磁共振氢谱有3组峰,其峰面积之比为1:2:2
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2.装置①中发生反应的化学方程式是__________________________;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请写出有关反应的化学方程式_________________________;
(2)SO3常温下是液体,16.8℃以下是无色或白色晶体。乙同学利用此套装置合成SO3,其反应为2SO2+O2 2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)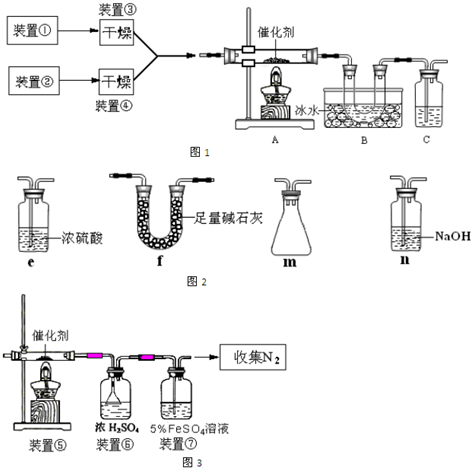
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是__________________________;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2L N2,则NO的转化率(转化率=已转化的量/原来的总量)是______________(能正确表达出计算过程即可)。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(已知Al(OH)3具有两性,既可与强酸反应,又可与强碱反应Al(OH)3+NaOH=Na[Al(OH)4]、CO32-与Al3+或Fe3+在水溶液中不能共存,会相互反应产生相应氢氧化物沉淀及CO2气体等)
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_________和_________(填化学式,且相对分子质量最小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解.则:X为_________;
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)向B的水溶液中逐滴加入盐酸且边加边振荡,发现基本没有气泡,原因是____________(用离子方程式表示);
(4)将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为______(保留两位小数)。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的_________(填相应的离子符号).有关反应的离子方程式为_________;
(6)利用上述已经确定的物质,可以检验出D中的阳离子.请简述实验操作步骤、现象及结论_________;
按要求写出下列反应的化学方程式或离子方程式:
(1)硝酸见光分解的化学方程式__________________________;
(2)氨的催化氧化反应的化学方程式__________________________;
(3)锌与稀硝酸按物质的量比2:5反应的离子方程式__________________________;
(4)NaHCO3溶液与少量Ca(OH)2溶液反应的离子方程式__________________________;
(5)Cu2S与稀硝酸反应产生硝酸铜、硫酸、一氧化氮和水的化学方程式__________________________;