碱金属元素的单质和化合物在日常生活和化工生产中应用广泛。
(1)钠的原子结构示意图为______________________。
(2)过氧化钠可作为呼吸面具和潜水艇中的供氧剂。写出过氧化钠与二氧化碳反应的化学方程式:___。
(3)氯碱工业是利用电解饱和食盐水获取一系列化工产品的过程。若利用电解饱和食盐水所得的气体制100t 36.5%的浓盐酸,理论上至少需要消耗NaCl_________________ t。
(4)某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
①分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A的名称为_______。
②称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,发现Na2CO3固体完全溶解,而NaHCO3固体还有剩余,由此可以得出结论:___________。向所得溶液中滴入酚酞后,观察到的现象是________________。
③某同学为探究Na2CO3和NaHCO3与CaCl2溶液的反应,将两种固体分别配制成0.5 mol/L的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 |
预测现象 |
预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32-=" " CaCO3↓。 |
| 操作2:向2mL NaHCO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为:___________________________。
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示.试回答下列问题: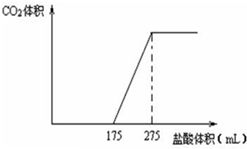
(1)反应后的固体的成分(填化学式)__________________;
(2)加入盐酸后总共产生的气体在标准状况下的体积为__________________;
(3)盐酸中HCl的物质的量浓度__________________;
(4)原固体混合物中m(NaHCO3)= ________、m(Na2O2)= ___________。
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL0.01 mol•L-1FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要______________;
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是__________。此液体具有的性质是_________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.向该液体中加入AgNO3溶液,无沉淀产生
d.该液体显酸性
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强.
①该过程反应的化学方程式为__________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:____Cu2S+____Fe3++ ____H2O ____Cu2++____Fe2++____+____SO42-
____Cu2++____Fe2++____+____SO42-
(4)羟胺(NH2OH)是 一种还原剂,用25.0mL0.49mol/L羟胺有酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液反应(反应后MnO4-离子变成Mn2+)。则在上述反应中,羟胺的氧化产物中N的化合价是________。
某混合物A中含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下列物质之间的变化: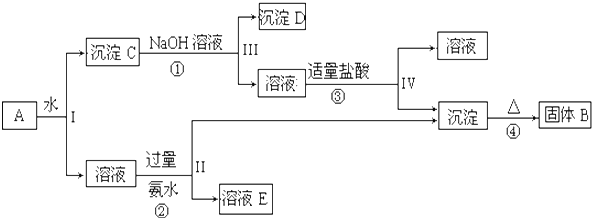
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、IV四步中对于溶液和沉淀采用的相同操作是______________。
(2)写出下列B、D、E所含物质的化学式:
固体B_______________沉淀D_______________溶液E_______________
(3)写出①、②、③、④过程中发生的三个离子反应方程式,反应④的化学方程式。
①_______________________________
②_______________________________
③_______________________________
④_______________________________
配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。该配合物的配体是_______,配位数是______。
(2)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在________。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(3)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象,则第一种配合物的结构式为______________,第二种配合物的结构式为______________,如果在第二种配合物溶液中滴加AgNO3溶液时,产生的现象是___________________。(提示:TiCl(H2O)5Cl2这种配合物的结构式可表示为[TiCl(H2O)5]Cl2)
碳、氧、氯、铁是与人类生产、生活息息相关的化学元素。
(1)基态铁原子的外围电子排布式为_________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是____________________。
(4)C、O、Cl三种元素的电负性由大到小的顺序为__________________(用元素符号表示)。COCl2俗称光气,分子中C原子采取__________杂化成键,根据原子轨道重叠方式的不同来看,碳原子与氧原子之间形成共价键的类型和数目为__________________。
(5)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是____________。