在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
| B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2有漂白性 |
| C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
运用有关概念判断下列叙述正确的是()
| A.1molH2燃烧放出的热量为H2的燃烧热 |
| B.Na2SO3和H2O2的反应为氧化还原反应 |
C.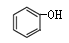 和 和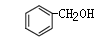 互为同系物 互为同系物 |
| D.BaSO4的水溶液不导电,故BaSO4是弱电解质 |
下列物质分类正确的是()
| A.SO2、SiO2、CO均为酸性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.福尔马林、水玻璃、氨水均为混合物 |
下列化合物的俗称与化学式不对应的是
| A.绿矾-FeSO4·7H2O | B.芒硝-Na2SO4·10H2O |
| C.明矾- Al2(SO4)3·12H2O | D.胆矾- CuSO4·5H2O |
下列关于溶液和胶体的叙述,正确的是( )
| A.溶液是电中性的,胶体是带电的 |
| B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
下列各项表达中正确的是( )
| A.Na2O2为共价化合物 |
| B.106 g的乙醇和丙醇混合液完全燃烧生成的CO2为112 L(标准状况) |
| C.在氮原子中,质子数为7而中子数不一定为7 |
D.Cl-的结构示意图为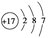 |