(1)3.4 g NH3中含氨分子约__________个,所含氢原子数目与标准状况下_________L CH4所含氢原子数相同。
(2)在一定条件下,44.8 g 单质R与1.2 mol Cl2完全反应,生成0.8 mol RClx,则x==_______,R的摩尔质量为_________________。
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活健康也与溶液的酸碱性有关,因此,测试和控制溶液的pH具有重要意义。
(1)常温下,下列事实一定能证明HA是弱电解质的是 。
①常温下HA溶液的pH小于7
②用HA溶液做导电实验,灯泡很暗
③常温下NaA溶液的pH大于7
④0.1mol/L HA溶液的pH=2.1
⑤将等体积的pH=2的HCl与HA分别与足量的Zn反应,放出的H2体积HA多
⑥pH=1的HA溶液稀释至100倍,pH约为2.8
(2)常温下,①将 pH=3的HA溶液与将 pH=11的NaOH溶液等体积混合后,溶液可能呈 (选填字母:a酸性、b碱性、c中性 )。
②将等物质的量浓度的HA溶液与NaOH溶液等体积混合后,溶液可能呈 (选填字母:a酸性、b碱性、c中性)。用离子方程式解释混合液②呈酸性或碱性的原因 。
(3)甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙烧杯中溶液的描述正确的是( )
A.溶液的体积10V甲≥V乙
B.水电离出的OH―浓度:10c(OH―)甲=c(OH―)乙
C.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
D.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
(4)若HA为弱酸,一定浓度的HA和NaA的混合溶液可作为控制体系pH的缓冲溶液,向缓冲溶液中加入少量的酸或碱,溶液pH 的变化很小,下列体系可作为缓冲溶液的有 。
A.氨水和氯化铵混合溶液 B.硝酸和硝酸钠溶液
C.盐酸和氯化钠混合溶液 D.醋酸和醋酸钠溶液
(5)某二元酸(化学式用H2B表示 )在水中的电离方程式是:H2B=H++HB﹣;HB﹣ H++B2﹣。在0.1mol·L﹣1的Na2B溶液中,c(B2﹣ ) + =0.1mol·L﹣1。
H++B2﹣。在0.1mol·L﹣1的Na2B溶液中,c(B2﹣ ) + =0.1mol·L﹣1。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=__________。
面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的主要方向。
(1) “生物质”是由植物或动物生命体衍生得到的物质的总和。生物质能主要是指用树木、庄稼、草类等植物直接或间接提供的能量.秸秆、杂草等废弃物经微生物发酵之后,便可以产生沼气,利用沼气是解决人类能源危机的重要途径之一。下面说法不正确的是( )
| A.利用生物质能就是间接利用太阳能,生物质能是可再生能源 |
| B.生物质能是解决农村能源的重要途径之一 |
| C.生物质能的缺点是严重污染环境 |
| D.若建立沼气发电站,则可以实现把生物质能转化为电能 |
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为 -890.3 KJ·mol-1、-285.8 KJ·mol-1、-283.0 KJ·mol-1,则该重整的热化学方式为 ;
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:
C(s) +CO2(g ) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。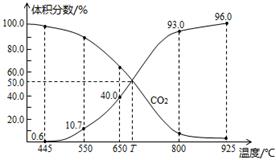
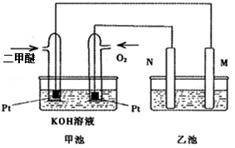
(4)如下图是一个二甲醚(CH3OCH3)燃料电池工作时的示意图,
①若乙池为粗铜的电解精炼,电解质为硫酸铜,则N电极材料为 。
②若乙池中M、N为惰性电极,电解质为足量硝酸银溶液,写出乙池中电解的化学方程式 。乙池中某一电极析出金属银2.16g时,溶液的体积为200mL,则常温下乙池中溶液的pH为 。
③通入二甲醚的铂电极的电极反应式为 。若该电池的理论输出电压为1.0V,则该电池的能量密度= kW·h·kg-1(结果保留小数点后一位).(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=9.65×l04C·mol-1 )。
(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是 (填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为 (填字母)。
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 。
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为 。
③铁是人们生活中常用的金属材料,请列举两种防止铁制品被腐蚀的方法: , 。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①pH< 的雨水称为酸雨;向煤中加入适量的 ,可以大大减少燃物产物中SO2的量。
②对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为 。
③天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是 ;加入明矾后,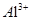 水解的离子方程式是 。
水解的离子方程式是 。
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为 。
(2)H、N、O的电负性从小到大的顺序是 。
(3)与NO2+互为等电子体的一种分子为 (填化学式)。氨基(-NH2)中氮原子的杂化类型为 。
(4)1mol苯分子中含有σ键的数目为 。
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为 。
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,现取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式______________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。