工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是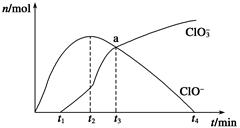
| A.工业制取漂白液的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O |
| B.a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+) |
| C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3- |
| D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
| A.NH4Cl | B.NH4HSO4 | C.CH3COONH4 | D.NH3.H2O |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.氯气在水中溶解度大于饱和食盐水中的溶解度 |
| D.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
一定温度下,满足下列条件的溶液一定呈酸性的是
| A.能与金属Al反应放出H2的溶液 |
| B.加酚酞后显无色的溶液 |
| C.pH=6的溶液 |
| D.c(H+)>c(OH-)的任意水溶液 |
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol·L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为
| A.(m-0.8)g | B.(m-1.2)g | C.(m-1.6)g | D.无法计算 |