铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(1)铝在反应中容易失去电子,发生 反应(填氧化或还原),生成铝离子,铝离子的结构示意图是 。
(2)生产中曾用铝热反应焊接钢轨,写出铝与氧化铁发生反应的化学方程式为并标出电子转移的方向和数目: 。
(3)胃舒平是治疗胃酸过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
(4)在同温同压下,等质量的铝分别投入足量的稀盐酸和NaOH溶液中,产生气体的体积之比为 。
(5)铝合金在空气中很稳定,可以制造多种建筑型材。向一只小烧杯里加入少量CuSO4溶液,把一小块铝合金浸入溶液中,1~2分钟后将铝合金取出,无明显现象。将另一小块铝合金先放入NaOH溶液里,片刻后取出,用蒸馏水冲洗后浸入CuSO4溶液里,1~2分钟后将铝片取出,发现铝片表面有亮红色的固体附着,NaOH溶液的作用是 。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度/mol·L-1 |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:__________________________。
(2)醋酸溶液中存在的微粒有__________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(选填“增大”“减小”或“不变”)__________。
(5)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO-)= (精确值,用表达式表示)。
(6)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加入少量冰醋酸
c.加入少量氯化钠固体
d.加热CH3COOH溶液
e.加入Zn粒
f.加入少量0.10 mol·L-1的CH3COONa溶液
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在同温度下反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
1 |
4 |
0 |
0 |
t1 |
放出热量:32.8 kJ |
|
| ② |
2 |
8 |
0 |
0 |
t2 |
放出热量:Q |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L·min)
(5)已知:2H2(g)+O2(g)==2H2O(g)ΔH=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式: 。
一定条件下,A(g)+B(g) 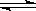 C(g) ΔH <0,达到平衡后根据下列图像判断:
C(g) ΔH <0,达到平衡后根据下列图像判断:
(1)升高温度,达到新平衡的是 (填“A”、“B”、“C”、“D”、“E”,下同),新平衡中C的体积分数 (填“增大”、“减小”、“不变”,下同)。
(2)减小压强,达到新平衡的是 ,A的转化率 。
(3)减小C的量,达到新平衡的是 。
(4)增加A的量,达到新平衡的是 ,此时B的转化率 ,A的转化率 。
(5)使用催化剂,达到新平衡的是 ,C的质量分数 。
近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表: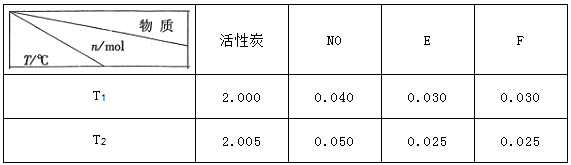
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= ,根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO)b.增大压强 c.升高温度d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示: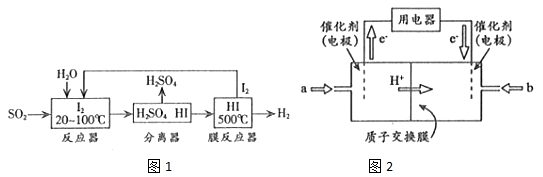
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的 极(填“正”或“负”),b电极反应式为 .
硫元素有多种化合价,可形成多种化合物.
(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,此反应的离子方程式为 ,请用离子方程式表示该溶液PH>7的原因 ,该溶液放置于空气中一段时间后,溶液的PH (填“增大”“减小”或“不变”)
(2)SO2能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 ,实验室通常选择 (选填“稀盐酸”、“稀硫酸”)对高锰酸钾溶液进行酸化.
(3)课本中选用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响.选用Na2S2O3来比较化学反应速率快慢的原因是 .