下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。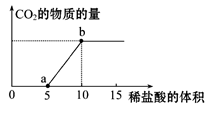
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为 mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为 mol。
已知在标况下的四种气体①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S
③13.6克H2S
④0.2molNH3用相应的序号填写下列空白:
(1)体积最大的是 ;(2)密度最大的是 ;
(3)质量最小的是 ;(4)含氢原子数最少的是 。
对于混合物的分离或者提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解 等。下列各组混合物的分离或提纯应采用什么方法?
等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)提取碘水中的碘,用 方法。
(3)除去食盐溶液中的水,可采用 方法。
(4)淡化海水,可采用 方法。
(5)除去氧化钙中的碳酸钙,可用 方法。
在 K2Cr2O7 + 14HCl ="===" 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
="===" 2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂,氧化产物是 ;
(2)此反应若转移了12mol的电子,则生成氯气 L(标准状况)
⑴钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________g
⑵超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂。请尝试写出超氧化钾与二氧化碳反应的化学方程式
__________________________________________________________________________,为了维持气压稳定可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为____________
⑶KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
(一)补全以下检验混合物中存在K2CO3的实验步骤及相关现象
1.取混合物样品溶于水,分别取少量溶液进行以下实验
2._________________________________________则一定存在K+;
3.___________________________________________________则一定存在CO32—。
(二)测定K2CO3质量分数
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是
。
(2)乙同学用图2代替图1中的收集装置,则所测K2CO3质量分数(填“偏大”、“偏小”、“不变”),你的改进方案是。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I;
Ⅱ
Ⅲ