以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+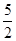 O2(g)
O2(g) 2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
| A.当10NA个电子转移时,该反应放出1 300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
某高聚物的结构为: ,其单体的结构简式为(
,其单体的结构简式为( )
)
下列有机化合物分子中,在核磁共振氢谱中只给出一种信号的是()
A.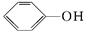 |
B.CH3CH2CH3 |
| C.CH3COOCH3 | D.C(CH3)4 |
要使蛋白质从溶液中析出而又不改变蛋白质的性质,应加入的试剂是()
| A.乙醇 | B.福尔马林 |
| C.(NH4)2SO4浓溶液 | D.(CH3COO)2Pb浓溶液 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是()
| A.蒸馏常用于分离提纯液态有机混合物 |
| B.燃烧法是研究确定有机物成分的有效方法 |
| C.核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
下列关于淀粉和纤维素的叙述中,不正确的是()
| A.它们都是混合物 |
| B.它们都是天然高分子化合物 |
| C.它们是同分异构体 |
D.它们水解 的最终产物都是葡萄糖 的最终产物都是葡萄糖 |