恒温恒压下向密闭容器中充入4molA和2molB,发生如下反应:2A(g)+B(g) 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1
B.若在恒压绝热条件下反应,平衡后n(c)<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
下列叙述正确的是
| A.2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l) △H=﹣1367 kJ·mol-1,则乙醇燃烧热△H=﹣1367 kJ·mol-1 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
| A.合成氨工业通常采用20 MPa~50 MPa压强,以提高原料的利用率 |
| B.合成氨工业中采用500℃反应温度,有利于氨的合成 |
| C.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 |
| D.阴暗处密封有利于氯水的储存 |
在密闭容器中发生下列反应aA(g) ⇌cC(g) +dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a>c+d |
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1 mol•L-1、0.3 mol•L-1、0.2 mol•L-1,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.4 mol•L-1 | B.Y2为0.4 mol•L-1 | C.X2为0.2 mol•L-1 | D.Z为0.3 mol•L-1 |
已知化学反应A2(g)+B2(g)===2AB(s)的能量变化如图所示,判断下列叙述中错误的是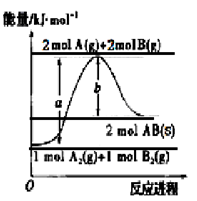
| A.该反应热ΔH=+(a-b)kJ·mol-1 |
| B.AB(s)=== A(g)+B(g) ΔH=+b/2kJ·mol-1 |
| C.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量 |
| D.该反应在任何条件下都不可能自发进行 |