(20分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为 。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________、__________________________、 。
(3)已知25℃时Ksp[Mg(OH)2]=1.2×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,则最先生成的沉淀的离子方程式为
。
(4)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(5)已知某温度下K(NH3·H2O)=1.69×10-5,
则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(6)又已知该温度下Ksp〔Mg(OH)2〕=1.2×10-11,
将0.01mol/L的MgCl2溶液与上述氨水等体积混合 (填“有”“无”)沉淀生成。往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH="10" 此时C(Mg2+)= mol/L。
.鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
⑴测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
⑵测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:Ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
⑶如果鸡蛋壳粉质量为m g,溶液中Y2-浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是 。
⑷有同学提出可采用如下装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的 量就能测定鸡蛋壳中的钙的总含量。
量就能测定鸡蛋壳中的钙的总含量。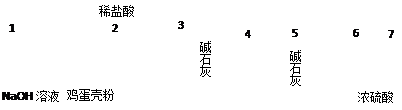




①采用该方法进行实验,各装置从左到右的连接顺序依次:
1—2—__ ______________ __(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
|
答:________(填“准确”、“不一定准确”或“无法判断”)。
原因是___________________ __ 。
。
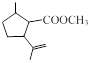
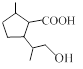
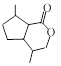
.1914年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。二氢荆芥内酯的合成路线如下: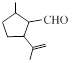
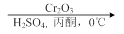 A
A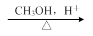
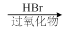 B
B 

⑴请写出A的结构简式_________________________。
⑵请写出生成B物质的化学方程式_____________________________________________。
⑶以上合成路线中发生取代反应的有_______步。
⑷ 含有的含氧官能团是_____________。
含有的含氧官能团是_____________。
⑸满足以下条件的 的同分异构体有__________种。
的同分异构体有__________种。
⑹请写出由CH2=CHCH2CHO合成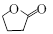 的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH
的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH CH2=CH2
CH2=CH2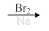 Br-CH2CH2-Br
Br-CH2CH2-Br
海水中提取镁的工业流程如下图所示:
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
A、B、C、D为四种中学化学中常见的单质。常温时A为淡黄色固体,B也是固体且B可被磁化;C和D是双原子分子的气体,C呈黄绿色。E、F、G、H、I为五种化合物,E难溶于水,F为气体,且极易溶于水得无色酸性溶液;H溶于水后得黄色或棕黄色溶液。它们之间有如下反应的转化关系: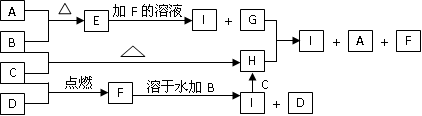
(1)四种物质的化学式:B________,C_______,E________,F_______;
(2)物质I溶液的颜色呈_______色;
(3)用实验方法鉴别H和I可用__________试剂,现象是_________________; (4)写出G+H I+A+F的离子方程式_______________________________。
(4)写出G+H I+A+F的离子方程式_______________________________。
宝石是一种贵重的首饰,石榴子石常用来制造宝石。常见的石榴子石有镁铝石榴子石(Mg3Al2Si3O12)、钙铝石榴子石(Ca3Al2Si3O12)等。请回答:
(1)用氧化物的形式表示钙铝石榴子石(Ca3Al2Si3O12):。
(2)从物质的分类来看,石榴子石属于硅酸盐,下列物质主要成分是硅酸盐的是。
| A.光导纤维 | B.水玻璃 | C.芯片 | D.大理石 |
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下: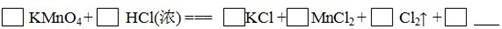
(3)把该化学方程式填写完整
(4)在该反应中,氧化剂是,还原剂是。(写化学式)