标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于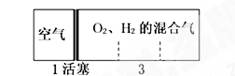
①2∶7 ②5∶4 ③4∶5 ④7∶2
| A.①② | B.②④ | C.③④ | D.①③ |
下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=13的氨水溶液稀释至10倍后pH=12 |
| C.0.2 mol/L的盐酸与等体积水混合后pH=1 |
| D.pH=12的氨水溶液与pH=2的盐酸等体积混合后pH=7 |
一定条件下,可逆反应C(s)+ CO2(g) 2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.①②③ | D.①③④ |
可逆反应aA(s)+bB(g) cC(g)+dD(g),当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
cC(g)+dD(g),当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
| A.T1>T2,正反应放热 |
| B.Tl<T2,正反应吸热 |
| C.P1>P2,a+b=c+d |
| D.Pl<P2,b=c+d |
某温度下在密闭容器中发生反应2M(g)+N(g) 2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
| A.20% | B.60% | C.80% | D.90% |
下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.减小体积 | B.加大X的投入量 |
| C.减压 | D.升高温度 |