某研究性学习小组进行了如下实验探究:将适量1.00 mol·L-1 CuSO4溶液和2.00 mol·L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2·CuSO4]。将9.08 g A隔绝空气在1000℃左右强热,得到了5.76 g砖红色固体B(铜的+1价氧化物),同时得到了混合气体C;再将5.76 g B溶于过量稀硫酸得到2.56 g另一种红色固体D和蓝色溶液。
(1)实验需用1.00 mol·L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需_________________________________;所称取的胆矾固体是________g;配制溶液浓度会导致所配溶液浓度偏高的是__________。
| A.称量质量正确,但胆矾晶体部分失结晶水 |
| B.配制溶液时,定容时仰视容量瓶刻度线 |
| C.称量胆矾时把胆矾放在右盘称 |
| D.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度 |
(2)B与稀硫酸反应的化学方程式为________________________________________。
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是______________。
(4)气体C的成分:__________________________(SO3和SO2不需填)。
(5)通过计算确定A的组成为_______________________________。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是,所用主要仪器名称为。
(2)提取碘的过程中,可供选择的有机试剂是(填序号)。
| A.酒精(沸点78℃) | B.四氯化碳(沸点77℃) |
| C.甘油(沸点290℃) | D.苯(沸点80℃) |
(3)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如上图所示)。请指出图中实验装置中错误之处
① _ ___,② ___
(4)实验中使用水浴的原因是,最后晶体碘聚集在(填仪器名称)中。
(5)②处反应化学方程式
某草酸亚铁样品中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5 Fe2+ +5C2O42—+3MnO4—+24H+="=5" Fe3+ +10CO2↑+3Mn2++12H2O。
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后(不含Fe3+),继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml。
③。
④数据处理。
请回答下列问题:
⑴上述实验方案中的步骤③是 ▲。
⑵洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、 ▲;
Ⅱ、用高锰酸钾标准溶液润洗滴定管;
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ、 ▲。
⑶步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 ▲溶液的试管中,如 ▲,则说明溶液合格。
⑷某实验探究小组的一次测定数据记录如下:
| a/g |
起始读数/mL |
b/mL |
c/mL |
| 0.1582 |
0.00 |
29.90 |
40.90 |
| 0.1582 |
0.00 |
30.10 |
41.10 |
| 0.1582 |
0.00 |
32.10 |
43.10 |
根据数据计算0.1582g样品中:n(Fe2+)= ▲; n(C2O42—)= ▲;
FeC2O4(FeC2O4的摩尔质量为144g/mol)的质量分数为▲。(精确到0.1%)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1).写出制取乙酸乙酯的化学反应方程式
(2).在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(3).浓硫酸的作用是:①;②。
(4).饱和碳酸钠溶液的主要作用是。
(5).装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6).若要把制得的乙酸乙酯分离出来,应采用的实验操作的名称是 。
(7).做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8).生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(共11分)实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水,加热装置未画出试回答:
(1)两套装置中的A、B处都需加热,A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,
B中反应的化学方程式为。
(3)若按乙装置进行实验,则B管中应装,B中反应的化学方程式为
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式。
已知: 2FeSO4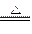 Fe2O3 +SO2↑+SO3↑
Fe2O3 +SO2↑+SO3↑
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2的沸点为-10.02℃,SO3的沸点为44.8℃)。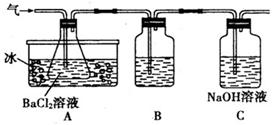
请回答相关问题:
(1)A中锥形瓶所盛试剂的作用是C瓶所盛试剂的作用是,用冷水冷却的原因是;B瓶所盛的试剂是。
(2)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是(填编号)
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
理由是。