已知有反应BrO3-+5Br-+6H+===3Br2+3H2O。下列反应中从反应原理来看与该反应最相似的是
A.2KNO3 2KNO2+O2↑ 2KNO2+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.3NO2+H2O===2HNO3+NO |
| D.SO2+2H2S===3S↓+2H2O |
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液滴加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL 0.2mol•L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g.
下列说法中正确的是
| A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
工业上用CO与H2合成甲醇,CO(g)+2H2(s) CH3OH(g)△H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g)△H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容量 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1 molCO、2molH2 |
1mol CH3OH |
2mol CH3OH |
|
| 平衡时 数据 |
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
a kJ |
b kJ |
c kJ |
|
| 体系压强(Pa) |
P1 |
P2 |
P3 |
|
| 反应物转化率 |
a1 |
a2 |
a3 |
下列说法正确的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
25℃时,有下列四种溶液,下列说法正确的是
| ① |
② |
③ |
④ |
| 0.1mol/L的氨水 |
pH=11的氨水 |
0.1mol/L的盐酸 |
pH=3的盐酸 |
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都成酸性
C.①②中分别加入少量CH3COONa固体,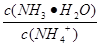 的值变小
的值变小
D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3∙H2O)> c(OH-)>c(H+)
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4LCCl4含有C—Cl键的数目为4NA |
| B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA |
C.反应NH4N3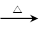 2N2↑+2H2↑,标准状况下每生成22.4LN2,转移电子的数目为2 NA. 2N2↑+2H2↑,标准状况下每生成22.4LN2,转移电子的数目为2 NA. |
| D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
某学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②荔枝酿酒和空气液化制取氮气的过程中都只发生物理变化;③冰和干冰既是纯净物又是电解质;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是
| A.①②④ | B.①④⑦ | C.③⑤⑥ | D.①⑤⑥ |