下列说法不正确的
A.氢硫酸溶液加水稀释,溶液中的离子浓度和导电性均减小,电离程度增大
B.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH—)
C.0.l mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(K+)-c(CH3COO-)>c(Na+)-c(F-)
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是:
A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高。
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
在一定温度下将1mol CO和9mol水蒸气放在密闭的容器中发生下列反应:
CO(g)+H2O(g)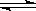 CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为()
CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为()
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.5mol |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
X、Y、Z三种气体,取X和Y按2:3的物质的量之比混合,放入密闭容器中发生如下反应:X+3Y 2Z,达到平衡后,测得平衡时混合气体的总物质的量是开始时混合气体物质的量的0.7倍,则Y的转化率最接近于( )
2Z,达到平衡后,测得平衡时混合气体的总物质的量是开始时混合气体物质的量的0.7倍,则Y的转化率最接近于( )
| A.37.5% | B.35% | C.50% | D.75% |
一定温度时于密封容器中发生反应:mA(g)+nB(g)  pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是
A.平衡向正向移动B.新平衡时,v正(A)=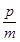 v逆(C)
v逆(C)
C.气体A的转化率升高 D.m+n>p