由于亚硝酸钠外观很像氯化钠而误作食盐使用引起中毒。某化学课外兴趣小组决定开展研究,寻求可行的方法,以鉴定某氯化钠样品中是否含有亚硝酸钠。为了解决这一问题,该小组查阅了大量的资料,对亚硝酸钠的相关信息归纳如下表:
| 亚硝酸钠 |
化学式为NaNO2,是亚硝酸(HNO2)的钠盐 |
| 物理 性质 |
白色至淡黄色粒状结晶或粉末,无味,易潮解,有毒,易溶于水,微溶于醇及乙醚,水溶液呈碱性,pH值约为9。密度:2.17g/cm3;熔点:271℃;沸点320℃(分解)。 |
| 化学 性质 |
氧化性:在酸性备件下能氧化KI,得到碘单质,自身被还原为NO气体 |
| 还原性:在酸性条件下能将KMnO4还原为Mn2+,自身被氧化为NO3- |
|
| 用途 |
抗氧化剂,防锈剂 |
某小组同学设计的方案如下:取少量固体,配成溶液。往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。如果溶液紫色褪去,说明该氯化钠样品中含有亚硝酸钠。
(1)写出上述设计方案的反应原理: 。(用离子方程式表示)
(2)亚硝酸钠溶液呈碱性的原因: 。(用化学方程式表示)
(3)该小组同学认为他们的方案还可测定样品中亚硝酸钠的含量。具体操作步骤如下:
a.称取一定量的样品,用25mL水溶解并置于锥形瓶中:
b.取酸性KMnO4溶液(过量)倒入锥形瓶中,振荡;
c.用草酸钠(Na2C2O4)溶液滴定过量的KMnO4;
d.重复上述操作。
①若每次实验时用到0.2000mol/L的酸性KMnO4溶液25.00mL,为减小试验误差,从中学角度看,量取酸性KMnO4溶液适宜使用的仪器是 。
②三次实验数据如下
| 实验次序 |
样品质量(g) |
滴定管中草酸钠溶液(浓度0.2500mol/L) |
|
| 滴定前滴定管读数(mL) |
滴定后滴定管读数(mL) |
||
| 1 |
5.0 |
0.00 |
12.78 |
| 2 |
5.0 |
1.50 |
14.32 |
| 3 |
5.0 |
1.25 |
15.05 |
己知:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O。
计算该样品中NaNO2的质量分数___(假设该样品中只含有NaC1和NaNO2)。
(4)根据上述信息和你所学过的化学知识,还可以设计其他实验方案以检验氯化钠样品中是否含有亚硝酸钠。试写出一种你所设计的方案(所用药品自行选择;简要写出实验操作、现象与结论、原理解释)
| 实验操作 |
现象与结论 |
原理解释(用离子方程式表示) |
| |
|
|
)(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:_____________________。
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
| 编号 |
① |
② |
③ |
④ |
| 装置 |
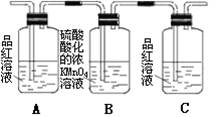 |
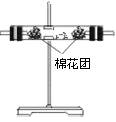 |
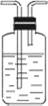 |
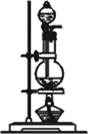 |
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):____→____→_____→______。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________,B瓶溶液的作用是_________________,C瓶溶液的作用是________________________。
(4)装置②中所加固体药品是______________,可验证的产物是______________,确定装置②在整套装置中位置的理由是_______________________________。
(5)装置③中所盛溶液是____________,可验证的产物是____________。
某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答: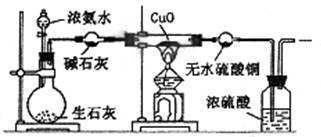
⑴实验前先将仪器按图连接好,然后,再开始实验。
⑵实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成色,
盛无水CuSO4的干燥管内出现色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中的反应方程式为(2分),这个反应说明氨气具有性。
⑶洗气瓶中浓硫酸的主要作用是。
⑷在最后出气管口收集干燥、纯净的氮气,收集方法是(填编号)
| A.向上排空气法 | B.向下排空气法 | C.排水法 | D.用塑料袋或球胆收集 |
(12分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
| 实验步骤 |
有关问题 |
| (1)计算所需KCl的质量 |
需要KCl的质量为______g |
| (2)称量KCl固体 |
称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 |
为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 |
为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 |
在进行此操作时应注意的问题是__________________________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
______________________________________________________
某同学应用如下所示装置研究物质的性质。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:

(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是____________________。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理_________________________________________
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
①生成的黑色(单质)物质是(填化学式)。
②这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为
③根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
④将实验②产生的刺激性气味气体通入氯水中,可以看到氯水_________ ,说明这种气体具有_____________________性;请写出该反应的化学方程式