T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
2 |
4 |
6 |
8 |
| n(Cl2) / mol |
0 |
0.16 |
0.19 |
0. 20 |
0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO)= 0.080mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)=" 0.11" mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
下列装置所示的实验中,能达到实验目的的是
23、由铁红、铁粉、和氧化亚铁组成的混合物中加入300 ml 1 mol·L-1的盐酸,恰好使混合物完全溶解,并放出672 ml气体(标准状态),往得到的溶液中加入硫氰化钾溶液不显红色,则下列判断中不正确的是
| A.混合物中铁单质物质的量的范围:0.03 mol < n(Fe) < 0.07 mol |
| B.往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 |
| C.混合物里FeO的量无法确定,也不好比较Fe物质的量和Fe2O3物质的量的多少 |
| D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶2 |
22、X、Y、Z、R、W是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为22。X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍。下列叙述正确的是
| A.原子半径:Y>Z>X |
| B.Y的最高价氧化物的水化物酸性比W的强 |
| C.W的气态氢化物的热稳定性比R的强 |
| D.W与Z形成的是共价化合物 |
21、将锌棒和铁棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是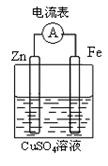
| A.将电能转变为化学能 |
| B.电子由铁棒流出 |
| C.锌为正极 |
| D.电池反应为:Zn + CuSO4 = ZnSO4 + Cu |
20、下列工业上制备物质的过程中,无氧化还原反应发生的是
| A.合成氨 | B.从铝土矿中获得铝 |
| C.玻璃制备 | D.从海水中获得氯气 |