化学反应原理在科研和生产中有广泛应用,运用化学反应原理知识分析下列问题。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
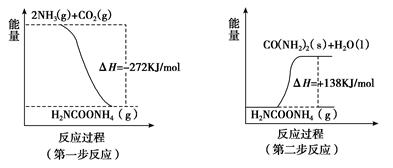
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为_______________。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如下图。
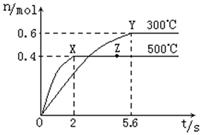
根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,
原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(3)工业生产中用SO2为原料制取硫酸
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式_____________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。

请写出开始时阳极反应的电极反应式_________。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)若Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为
(2)试写出Pb2O3与浓盐酸反应的化学方程式
(3)通过计算确定y与a、x的函数关系式____________________________。
实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: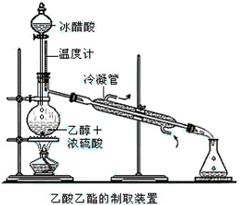
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是___________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是: 。
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?,原因是。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。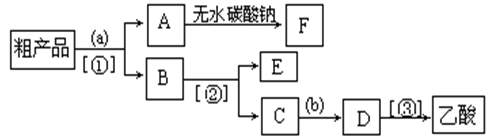
试剂a是__________,试剂b是_______________;分离方法①是__________,分离方法②是__________________,分离方法③是_______________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是
。
(6)写出C → D 反应的化学方程式。
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: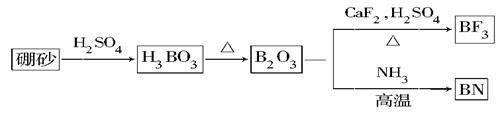
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________、____________________;
(2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,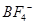 的立体构型为________;
的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
(1)下列方法可以证明2HI(g)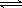 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)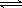 2SO3(g)。研究发现,
2SO3(g)。研究发现,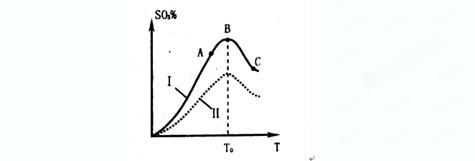
SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为(填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为