氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
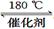
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) △H<0
2N2(g)+3H2O(g) △H<0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:NO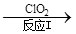 NO2
NO2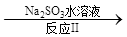 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1/ 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= 0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,
则该反应的△H <0(填“>”、“=”或“<”).
下列反应的离子方程式书写正确的是
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++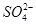 =BaSO4↓
=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH-+2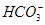 =CaCO3↓+
=CaCO3↓+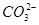 +2H2O
+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸: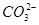 +H+=
+H+=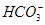
| A.①②⑤ | B.②③④⑤⑧ | C.④⑤⑥⑦ | D.②③⑧ |
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+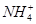 + +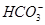 =BaCO3↓+NH3·H2O+H2O =BaCO3↓+NH3·H2O+H2O |
| B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O |
C.向亚硫酸钠溶液中加入足量硝酸: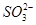 +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+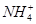 |
已知电离平衡常数:H2CO3>HClO>HCO,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是
| A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl- |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+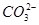 |
| D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
下列有关的离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= +4 +4 |
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液: |
C.磷酸一氢钠溶液水解: +H2O +H2O  +H3O+ +H3O+ |
| D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热: +OH-=NH3↑+H2O +OH-=NH3↑+H2O |
D.用酸化的高锰酸钾溶液氧化双氧水:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |