某微粒用符号ZAMn+表示,下列关于该微粒的叙述正确的是
| A.所含质子数为(A-n) | B.所含中子数为(A-Z + n) |
| C.所含电子数为(Z-n) | D.中子数-电子数=A-2Z-n |
下列配制1.0mol/L的NaOH溶液的操作不会造成误差的是
| A.称量后转移固体时不小心把少量固体洒到烧杯外 |
| B.干净的容量瓶又用蒸馏水洗涤了一遍 |
| C.转移过程中不小心把几滴溶液滴在外面 |
| D.加水定容时,加水过多,倒出后并恢复到刻度线水平 |
300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为
| A.1∶4 | B.1∶5 | C.2∶1 | D.2∶3 |
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为
A.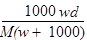 |
B.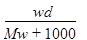 |
C.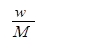 |
D.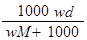 |
某硝酸的物质的量浓度为c mol/L,溶质的质量分数为a%,则此溶液的密度(g/cm3)为
A.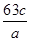 |
B.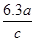 |
C.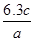 |
D. |
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.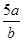 mol/L mol/L |
B.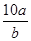 mol/L mol/L |
C.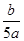 mol/L mol/L |
D.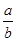 mol/L mol/L |