合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 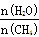 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: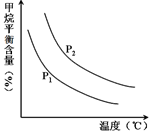
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g)  CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该反应平衡常数的表达式为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) =" 1" : 1 : 1 : 1
下图为相互串联的甲、乙两电解池,试回答:
(1)若甲池利用电解原理在铁上镀银,则A是_____________、_____________(填电极材料和电极名称),电极反应是__________________________;B(要求同A)是______________、___________,电极反应式是_____________________________________________,应选用的电解质溶液是_____________。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈_____________色,C极附近呈_____________色。
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积_____________mL。
(4)若乙槽中剩余溶液仍为400mL,则电解后所得溶液的物质的量浓度为_____________mol·L-1,pH等于_____________。
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、A3+、Fe3+和阴离子OH-、 、
、 、
、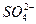 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。写出它们的化学式:
A:_____________,B:_____________,C:_____________D:_____________。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
— |
— |
— |
— |
— |
— |
↓ |
| B |
— |
— |
— |
— |
↓ |
↓ |
↓ |
| C |
— |
— |
— |
↓ |
— |
↓ |
↓ |
| D |
— |
— |
↓ |
— |
↓ |
↓ |
↓ |
| E |
— |
↓ |
— |
↓ |
— |
↓ |
— |
| F |
— |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
— |
有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显变化。试回答下面问题:
(1)A的化学式是_________,G的化学式是_________,判断理由是____________________。
(2)写出其余几种物质的化学式:B:______________,C:______________,D:______________,E:______________,F:______________。
向橙色的溴水中撒入足量的镁粉,充分振荡后过滤,溶液呈现___________色,原因是______________________。若向滤液中加入适量的氯水后,溶液呈___________色,原因用离子方程式表示为_________________________。
若向此滤液中加入适量的硝酸银溶液,溶液中有___________生成,原因用离子方程式可表示为_________________________________。
(8分)硫酸是许多化学工业的原料,其消费量可作用一个国家工业发展水平的一种标志。硫酸工厂厂址的选择是一个复杂的问题,下图是影响化工厂选址的部分因素。又已知硫酸是一种腐蚀性液体,不便较多贮存,需随产随销。另外,硫酸的运输价格也比较贵,据估算1t H2SO4的运价约为同质量黄铁矿石的三倍。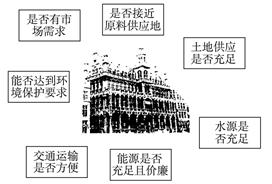
据以上信息,分析下列条件:
条件(Ⅰ)
①A城市郊区有丰富的黄铁矿资源,水源、能源充足,交通方便。
②A城市需使用硫酸的工业不多,而离它远的B城市却是一个消耗硫酸甚多的工业城市。
③A城市是一个风光秀丽的旅游城市,对环境保护的要求甚高,而且土地价格较贵,土地供应紧张。
条件(Ⅱ)
①C地是重要的农业区,需消耗大量的肥料。
②C地有丰富的磷灰石矿藏,水源、能源充足,土地价格较低,土地供应充足,交通方便。
③磷肥是由磷灰石〔有效成分是Ca3(PO4)2〕与H2SO4作用制得的,制造磷肥需消耗大量的硫酸。
④C地无磷肥厂和硫酸厂,在相邻的D地有丰富的黄铁矿资源。
在A、B、C、D四城市中,你认为应该建设硫酸工厂的城市是______________,应该建造磷肥厂的城市是______________。