如图所示是298 K时N2与H2反应过程中 ,能量变化的曲线图.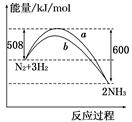
下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4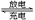 2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是()
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是()
| A.放电时PbO2是电池的负极 |
| B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 |
| D.充电时,该电池的正极接电源的负极 |
某反应A + B =" C" + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是()
| A.△H <0、△S >0 | B.△H >0、△S >0 |
| C.△H <0、△S <0 | D.△H >0、△S <0 |
下列说法正确的是()
A.某温度时, 1LpH=6的水溶液,含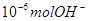 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于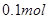 |
| C.VL amol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的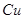 原子数必为 原子数必为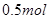 |
一定条件下,有关金属腐蚀的下列说法不正确的是()
| A.为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 |
| B.在pH<5的溶液中,金属主要发生析氢腐蚀 |
| C.钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- |
| D.在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
已知反应I2(g)+H2(g) 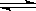 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
| A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数 |
| B.升高温度将缩短达到平衡的时间 |
| C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大 |
| D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小 |