现在有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:
| 物质 |
熔点 |
沸点 |
密度 |
水中溶解性 |
| 甲 |
–98℃ |
57.7℃ |
0.93g· |
可溶 |
| 乙 |
–84℃ |
77℃ |
0.90g· |
可溶 |
据此,将甲和乙互相分离的最佳方法是
A.萃取法 B.过滤法 C.蒸馏法 D.分液法
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为()
A、 A﹥B﹥E﹥D B、 A﹥B﹥D﹥E
C、 D﹥E﹥A﹥B D、 D﹥A﹥B﹥E
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质分别是()
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨) + O2(g) ==== CO2(g) 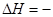 393.51 kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)
393.51 kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)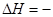 395.41 kJ/mol②,据此判断,下列说法正确的是()
395.41 kJ/mol②,据此判断,下列说法正确的是()
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
下列实验过程中,发生吸热反应的是()
| A.铝粉与氧化铁粉末反应 | B.乙醇燃烧 |
| C.碳酸钙受热分解 | D.碘单质升华 |
理论上不能用于设计成原电池的反应是()
| A.HCl+NaOH= NaCl+H2OΔH<0 |
| B.2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l)ΔH<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g) = 4 Fe(OH)3(s)ΔH<0 |
| D.2H2(g)+O2(g)=2H2O(l) ΔH<0 |