下列离子方程式中,正确的是
| A.碳酸氢钠溶液与稀盐酸混合:HCO3-+H+===H2O+CO2↑ |
| B.稀硫酸滴在铁片上: 2Fe+6H+===2Fe3++3H2↑ |
| C.硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+SO42- |
| D.硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+NO3- |
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是()
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是()
| A.升高温度 | B.加水稀释 |
| C.增大Fe2+的浓度 | D.常温下加压 |
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是()
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是()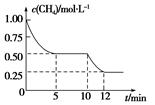
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图所示。下列有关说法不正确的是()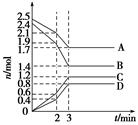
A.该反应的化学方程式为4A+5B6C+4D
B.前2 min用B表示的反应速率约为0.002 1 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.该反应为放热反应
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是()
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是()
A.2SO2+O2 2SO3 2SO3 |
B.CO+H2O(g) CO2+H2 CO2+H2 |
C.CO2(g)+H2O H2CO3 H2CO3 |
D.Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |