根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法正确的是
| A.标况下,燃烧1mol S吸收的热量为297.23 kJ |
| B.S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ |
| C.S ( g ) + O2 ( g ) = SO2 ( g )放出的热量小于297.23 kJ |
| D.形成1 mol SO2的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
胶体区别于溶液和浊液最本质的特征是 ( )
| A.有丁达尔效应 | B.分散质粒子的直径大小 |
| C.可以通过滤纸 | D.分散质粒子因吸附而带电荷 |
下列关于摩尔的叙述正确的是()
| A.表示物质数量的单位 | B.表示物质质量的单位 |
| C.表示物质微粒的单位 | D.表示物质的量的单位 |
将pH=13的NaOH溶液平均分成两份,一份加适量水,另一份加入与该NaOH溶液物质的量浓度相同的适量硫酸后,pH都降低了1,则加入的水与硫酸的体积比为( )
| A.10:1 | B.11:1 | C.20:1 | D.21:1 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正
确的是 ( )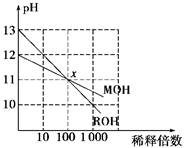
| A.在x点时,ROH完全电离 |
| B.在x点时,c(M+)>c(R+) |
| C.MOH是一种强碱 |
| D.稀释前,c(ROH)=10c(MOH) |
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是 ( )
| A.HA较强 | B.HB较强 | C.两者一样 | D.无法比较 |