已知:可逆反应N2(g)+3H2(g )
) 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
| A.达平衡时甲中N2的转化率为75% |
| B.达平衡时甲、乙中NH3的体积分数乙>甲 |
| C.达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 |
D.乙中反应的热化学方程式为2NH3(g)  N2(g)+3H2(g)△H=+Q2kJ/mol N2(g)+3H2(g)△H=+Q2kJ/mol |
皮肤上若沾有少量苯酚,正确的处理方法是
| A.用70℃热水洗 | B.用酒精洗 | C.用稀NaOH溶液洗 | D.不必冲洗 |
用核磁共振的方法测定结构简式为CH3OCH3的有机物结构,其1H核磁共振谱图为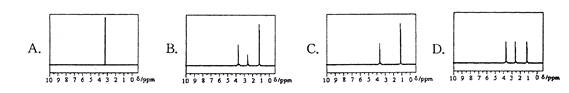
据央视报道,自2005年12月1日起在武汉市进行车用乙醇汽油推广行动。车用乙醇汽油是把燃料乙醇和汽油按一定比例混配形成的一种新型汽车燃料,经多项检测结果表
明,它不影响汽车的行驶性能,还可以减少有害气体的排放量。在美国、巴西等国早已推
广使用。下列有关乙醇汽油的说法正确的是
| A.乙醇汽油是一种纯净物 |
| B.乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 |
| C.乙醇和汽油都可作溶剂,也可相互溶解 |
| D.乙醇和乙二醇互为同系物 |
绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.甲烷、CO合成乙酸乙酯:2CH4+2CO CH3COOCH2CH3 CH3COOCH2CH3 |
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 RCH2CH2CHO RCH2CH2CHO |
| C.乙醇催化氧化得乙醛 |
| D.氯乙烯合成聚氯乙烯 |
828年德国化学家维勒以无机物为原料制得了有机物,打破了只能从有机体中取得有机物的学说,这种有机物是
| A.葡萄糖 | B.甘油 | C.尿素 | D.结晶牛胰岛素 |