下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是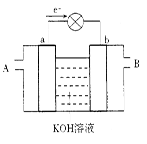
| A.A处通入的是空气,B处通入的是水煤气 |
| B.a电极发生还原反应,b电极发生氧化反应 |
| C.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O |
| D.如用这种电池电镀铜,待镀金属上增重6.4 g,则至少消耗标准状况下的水煤气2.24 L |
周期表中关于主族元素性质的下列叙述不正确的是
| A.主族序数等于原子最外层电子数 |
| B.主族元素最高正化合价等于最外层电子数 |
| C.第n主族元素其最高正化合价为+n价,最低负化合价绝对值为8-n(n≥4) |
| D.第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn(n≥4) |
与图像有关的叙述,正确的是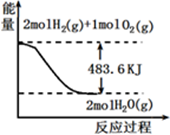
| A.表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 |
| B.表示的热化学方程式为:H2(g)+ 1/2 O2(g) =H2O(g) △H=-241.8 kJ·mol-1 |
| C.H2O(g)的能量低于H2(g)和O2(g)的能量之和 |
| D.表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子电子层结构。则下列有关说法中错误的是
| A.1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为 |
| D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑ |
下列表示电子式的形成过程正确的是
A.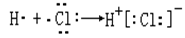 |
B.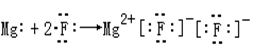 |
C. |
D. |
有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素。已知:①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的电子层数:B=C=2A;④B元素的最高正价与最低负价的绝对值之差为2;⑤F为地壳中含量第二的金属元素。下列说法正确的是
A.B的氧化物对应水化物为强酸
B.F单质与C单质反应的产物只有一种
C.因为E单质的相对分子质量小于溴单质的相对分子质量,所以E单质的熔点比溴单质要低
D.A、D形成的化合物的水溶液呈碱性