下列反应的离子方程式正确的是
| A.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| B.盐酸与醋酸钠溶液反应:H++CH3COO-=CH3COOH |
| C.向FeI2溶液中通人少量氯气:2Fe2++Cl2=2Fe3++2Cl-- |
| D.向NH4A1(SO4)2溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3·H2O |
下列关于杂化轨道的叙述中,正确的是()
| A.分子中中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构 |
B.CuSO4中氧原子杂化类型 有两种,分别为sp2 和sp3杂化 有两种,分别为sp2 和sp3杂化 |
| C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C分别是通过sp2 和sp3杂化轨道成键 |
| D.杂化轨道可用于形成σ键或用于形成π键 |
下列关于物质结构的说法中正确的是()
| A.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物是共价型化合物 |
| B.某元素原子最外层电子数是次外层电子数的a倍,则该原子核内质子数为a+2 |
| C.D2O分子与H2O分子是所含电子总数不相等的极性分子 |
| D.离子化合物NaxNO4中,NO4X-中的各原子最外层都达8电子稳定结构,则x=3 |
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子 不能产生NMR现象( )
不能产生NMR现象( )
A.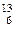 C C |
B.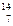 N N |
C.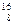 O O |
D.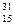 P P |
下列排列顺序正确的一组是
| A.半径:Fe(OH)3胶粒>I->K+>Na+ | B.熔沸点:HF<HCl<HBr<HI |
| C.还原性:Fe3+>Cu2+>Fe2+>Zn2+ | D.热稳定性:HF< PH3<H2S<HCl PH3<H2S<HCl |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中不正确的是( )
| A.6 g金刚石所含碳碳键数为NA |
| B.1mol二氧化硅晶体中,Si—O键数目为4NA; |
| C.58.5 g氯化钠分子中含有1molNa+和1mol Cl- |
| D.31 g白磷分子中,含有的共价单键数目是1.5NA个 |