今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(注:已知NH4+ + OH-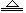 NH3↑ + H2O)第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.04mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g综合上述实验,你认为以下结论正确的是
NH3↑ + H2O)第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.04mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g综合上述实验,你认为以下结论正确的是
| A.该混合液中一定含有:NH4+、CO32-、SO42-、Cl- |
| B.该混合液中—定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ |
| D.该混合液中:c(K+) ≥ 0.2mol/L c(CO32-) = 0.2mol/L |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、 Z同周期。Z能与X形成两种常见的离子化合物,离子个数比均为2:1。下列说法错误的是
| A.Y、Z、X、W的原子序数依次减小 |
| B.W与X可形成既含极性共价键又含非极性共价键的化合物 |
| C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性 |
| D.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
| A.该氖原子的相对原子质量为12a/b |
| B.Wg该氖原子的物质的量为W/aNA mol |
| C.Wg 该氖原子所含的质子数为 10W/a个 |
| D.氖元素的摩尔质量为aNA g/mol |
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
| A.电极甲为电池正极 |
| B.电池总反应为4NH3+5O2=4NO+6H2O |
| C.电池正极反应式为O2+2H2O+4e-=4OH- |
| D.图示中的O2-由电极乙移向电极甲 |
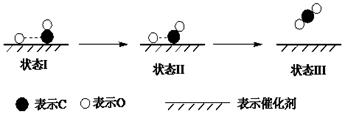
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: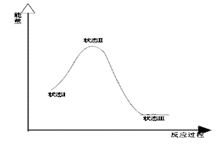
下列说法正确的是
| A.CO和O生成CO2是吸热反应 |
| B.在该过程中,CO断键形成C和O |
| C.CO和O生成了具有极性共价键的CO2 |
| D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.元素Z、W的简单离子的电子层结构不同 |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |