将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀18.00 g,滤液质量比石灰水减少5.22 g,该有机物可能是
| A.乙烯 | B.乙二醇(HO—CH2—CH2—OH) |
| C.丙烷 | D.甲酸甲酯(HCOOCH3) |
下列有关说法正确的是
| A.苯可以使溴水褪色是因为发生了取代反应生成溴苯 |
| B.将金属钠放入乙醇中,反应较缓和且钠在液面下 |
| C.在蛋白质溶液中滴加饱和硫酸铵溶液可以使蛋白质变性 |
| D.淀粉、脂肪和纤维素都是天然高分子化合物 |
下列关于有机物存在的叙述中,错误的是
| A.工业酒精中含有乙醇和甲醇 |
| B.许多水果中含有酯类化合物 |
| C.天然油脂中含有高级脂肪酸甘油酯 |
| D.煤中含有苯和甲苯 |
化学反应N2+3H2= 2NH3的能量变化如下图所示,该反应的热化学方程式是
| A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a—b—c)kJ·mol-1 |
| B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b—a)kJ·mol-1 |
C. N2(g)+ N2(g)+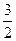 H2(g) = NH3(l) ;⊿H = (b+c—a)kJ·mol-1[来源:Z&xx&k.Com] H2(g) = NH3(l) ;⊿H = (b+c—a)kJ·mol-1[来源:Z&xx&k.Com] |
D. N2(g)+ N2(g)+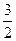 H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1 H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1 |
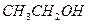 和
和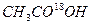 在一定条件下充分反应后,得到的产物为()
在一定条件下充分反应后,得到的产物为()
A.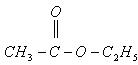 和 和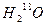 |
B. 和 和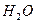 |
C. 和 和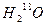 |
D.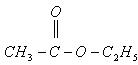 和 和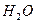 |
下列说法中,正确的是()
A.在 四种元素中,最高正化合价数值最大的是P 四种元素中,最高正化合价数值最大的是P |
B.在N、F、Mg、Cl四种元素中,原子半径最小的是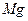 |
| C.原子序数从3—10的元素,随着核电荷数的递增,原子的最外层电子数递增 |
D. (硅烷)比 (硅烷)比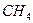 稳定 稳定 |