设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,22.4 L H2O含有分子数为NA |
| B.分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g |
| C.常温常压下,1.6 g CH4含原子数为0.5NA |
| D.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾中小水滴直径范围是()
| A.小于1nm | B.在1nm~100nm间 |
| C.大于100nm | D.无法确定 |
常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,气球体积依次增大,其中的气体为 CH4 的是()
下列反应中,水作氧化剂,且该反应属于置换反应的是()
| A.H2O+Cl2 ="HCl" +HClO | B.2F2 +2H2O =" 4HF" + O2↑ |
| C.2Na + 2H2O =" 2NaOH" +H2↑ | D.2H2O 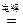 2H2↑ +O2↑ 2H2↑ +O2↑ |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是()
A.100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.1NA |
B.1 mol大米中含有NA个大米粒子 |
C.2.7g金属铝与足量的盐酸反应,铝失去电子数为0.3NA |
D.常温常压下,11.2L甲烷所含的分子数为0.5NA |
在0.5 L某浓度的Na2SO4溶液中含有0.5 mol Na+,对该溶液的说法不正确的是()
| A.该溶液的物质的量浓度为1 mol·L-1 |
| B.该溶液中含有35.5 g Na2SO4 |
| C.配制100 mL该溶液需用7.1 g Na2SO4 |
| D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol |