下列实验操作中错误的是
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
下列各组物质中,不属于同系物的是()
| A.CH2=CH2与CH2=CH—CH=CH2 | B.CH≡与CH3—CH2—C≡CH |
| C.CH3OH与CH3CH2OH | D. |
某烃结构式如下: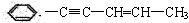 ,有关其结构说法正确的是()
,有关其结构说法正确的是()
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |
茉莉醛具有浓郁的茉莉花香,其结构简式如下图所示:关于茉莉醛的下列叙述错误的是
()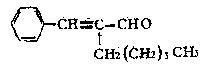
| A.在加热和催化剂作用下,能被氢气还原 |
| B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与银氨溶液反应生成银镜 |
| D.不能与HCl发生加成反应 |
下列物质既能发生消去反应的是()
| A.一氯甲烷 | B.1—氯—2,2—二甲基丙烷 |
| C.1—溴—2—甲基丙烷 | D.苯酚 |
乙醇分子中不同的化学键如右图。下列关于乙醇在不同的反应中断裂化学键的说法错误的是()
| A.与金属钠反应时,键①断裂 |
| B.与乙酸在浓硫酸作用下反应时,键②断裂 |
| C.在Cu催化下与O2反应时,键①、③断裂 |
| D.与浓硫酸共热至140℃时,键①或键②断裂;共热至170℃时,键②、⑤断裂 |