氰化钠(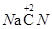 )是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为2Na+2C+2NH3 =2NaCN+3H2↑该反应中的还原剂为
)是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为2Na+2C+2NH3 =2NaCN+3H2↑该反应中的还原剂为
| A.NH3 | B.C和Na | C.Na和NH3 | D.C和NH3 |
以下离子检验的结论可靠的是()
| A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+ |
| B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I- |
| C.往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32— |
| D.往溶液中加入 BaC12溶液和稀 HNO3 ,有白色沉淀生成,说明有SO42- |
离子检验的常用方法有三种:
| 检验方法 |
沉淀法 |
显色法 |
气体法 |
| 含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是()
A NH4+-气体法 B I--沉淀法 C Fe3+-显色法 D Ca2+-气体法
下列各组稀溶液,不用其他试剂或试纸,仅利用溶液间的相互反应,就可以将它们区别开的是()
| A.硝酸钾、硫酸钠、氯化钙、氯化钡 | B.硫酸、硫酸铝、氯化钠、氢氧化钠 |
| C.盐酸、硫酸钠、碳酸钠、氢氧化钠 | D.硫酸氢钠、硫酸镁、碳酸钠、氢氧化钠 |
以乙炔为原料制取CH2Br—CHBrCl,可行的反应途径为()
| A.先加Cl2,再加Br2 | B.先加Cl2,再加HBr |
| C.先加HCl,再加HBr | D.先加HCl,再加Br2 |
二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别列表如下:
| 一溴代二甲苯 |
234°C |
206°C |
213.8°C |
204°C |
214.5°C |
205°C |
| 对应二甲苯 |
13°C |
-54°C |
-27°C |
-54°C |
-27°C |
-54°C |
由表内数据可以推断,熔点为234°C的一溴代二甲苯的结构简式为,熔点为-54°C的二甲苯的名称为。