常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是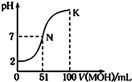
| A.HA为一元强酸,MOH为一元强碱 |
| B.N点水的电离程度小于K点水的电离程度 |
| C.K点所示溶液中c(A-)>c(M+) |
| D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
下列叙述中,正确的是
| A.硅化学性质很稳定,因此硅在自然界中以游离态形式存在 |
| B.实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| C.实验室盛装NaOH溶液的试剂瓶要用橡皮塞而不用玻璃塞 |
| D.向待测液先滴加新制氯水再滴加KSCN溶液,溶液变成血红色,说明待测液中一定有Fe2+ |
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是
| A.AgNO3 | B.FeSO4 | C.MgCl2 | D.(NH4)2SO3 |
下列反应的离子方程式正确的是
| A.氨水中通入少量的SO2气体: SO2+ OH— ="=" HSO3— |
B.氯气与水的反应: Cl2+H2O 2H++Cl-+ClO— 2H++Cl-+ClO— |
| C.氯化钙溶液中通入CO2气体: Ca2++H2O+CO2="=" CaCO3↓+2H+ |
| D.向澄清的石灰水中滴加少量的小苏打溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
关于一些重要的化学概念有下列说法:①AgCl是一种难溶于水的电解质;②水玻璃是硅酸钠的俗名,也是电解质;③硝酸、纯碱、小苏打分别属于酸、碱、盐;④氧化还原反应都属于离子反应;⑤酸雨是指pH小于7.0的降水;摩尔是国际科学界建议采用的七种基本物理量之一;⑦丁达尔效应可以区分溶液和胶体;⑧酸性氧化物:SiO2、NO2、SO3、NO;其中正确的是
| A.①⑦ | B.②⑦ | C.③④ | D.④⑤ |
下列说法中正确的是
| A.用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+ |
| B.次氯酸盐在酸性条件下有漂白性,故漂白粉的有效成分是次氯酸钠 |
| C.三峡工程可以提供清洁水发电,相当于每年5000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制酸雨的形成和温室效应 |
| D.Na2O与Na2O2都能和水反应生成NaOH,所以它们都是碱性氧化物 |