下列叙述正确的是
| A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同 |
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中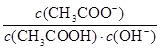 减小 减小 |
| C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH |
| D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-) |
25℃时,在0.5L 0.2mol/L的HA溶液中,有0.01mol/L的HA电离成离子。求该温度下HA的电离常数。
在常温下,将PH=11的某碱溶液和PH=3的某酸溶液等体积混合后,下列说法正确的是( )
| A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐 |
| B.若所得溶液呈碱性,则可能是强碱与弱酸溶液反应 |
| C.若所得溶液呈酸性,则可能是强酸与弱碱溶液反应 |
| D.若所得溶液的PH=5,则可能是强碱与弱酸溶液反应 |
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是( )
A.H2Y在电离时:H2Y+H2O HY-+H3O+ HY-+H3O+ |
| B.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
| C.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
D.HY-水解方程式为:HY-+H2O Y2-+H3O+ Y2-+H3O+ |
用物质的量均是0.1mol的CH3COOH和CH3COONa配成1L溶液,c(Na+)<c(CH3COO-)下列判断正确的是( )
| A.c(OH-)<c(H+) | B.c(CH3COOH)+c(CH3COO-)=0.2mol/L |
| C.c(CH3COOH)>c(CH3COO-) | D.c(CH3COO-)+c(OH-)=0.1mol/L |
在室温下,将等体积的酸溶液和碱溶液混合,其溶液的PH一定大于7的是( )
| A.PH=2的盐酸跟PH=12的氢氧化钠溶液 |
| B.PH=2的醋酸和PH=12的氢氧化钾溶液 |
| C.PH=2的硝酸跟PH=12的氢氧化钡溶液 |
| D.PH=2的硫酸跟PH=12的氨水 |