某硫酸厂废气中SO2的回收利用方案如右下图所示。下列说法不正确的是
| A.X可能含有2种盐 | B.a是SO3 |
| C.Y可能含有(NH4)2SO4 | D.(NH4)2S2O8中S的化合价可能为+7 |
下列反应的离子方程式正确的是
| A.Na2CO3溶液与NaHSO4溶液反应:CO32--+2H+=CO2↑+H2O |
| B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C.碘化钾溶液中滴入稀硫酸酸化的双氧水反应:2I-+H2O2+2H+=H2O+I2 |
| D.海水制取溴时用纯碱吸收吹出的溴:3Br2+3H2O=5Br-+BrO3-+6H+ |
对于能水解的链状有机物C4H6O2,下列说法正确的是
| A.该物质不能使溴的CC14溶液褪色 | B.该物质一定不能发生取代反应 |
| C.该物质可能的结构共有5种 | D.该物质与C2H4O2可能互为同系物 |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙
2NH3(g),△H=-92.4 kJ.mol-1下列叙
述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑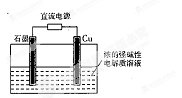
下列说法不正确的是
| A.石墨电极上产生氢气 |
| B.铜电极发生的电极反应为:2Cu -2e-+2OH-= Cu2O+H2O |
| C.铜电极接直流电源的正极 |
| D.当有0.1 mol电子转移时,有0.1 molCu2O生成 |
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |