五种短周期元素在周期表中的位置如图所示,其中Z元素原子的最外层电子数等于电子层数。下列判断正确的是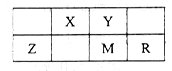
| A.Z的氧化物可以做光导纤维 |
| B.气态氢化物稳定性:M>R |
| C.最高价氧化物对应水化物的酸性:Y>X |
| D.Z、M、R的原子半径依次增大,最高化合价依次升高 |
下列有关实验的现象描述正确的是
| A.氢气在氯气中燃烧,火焰呈苍白色,产生大量白雾 |
| B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 |
| C.铜在氯气中燃烧,产生白烟,加水溶解后可能得到绿色溶液 |
D.用洁净的玻璃棒蘸取碳酸钾粉 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
下列有关化学用语正确的是
A.碳原子的轨道表示式: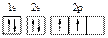 |
B.次氯酸分子的电子式: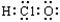 |
C.CH4Si的结构式: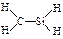 |
D.质量数为137的钡原子: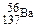 |
下列生产工艺不能体现“绿色化学”或环保思想的是
| A.海水提镁:用电解氯化镁产生的氯气制取盐酸 |
| B.工业制硫酸:提高尾气排放的烟囱高度 |
| C.工业制胆矾:使用稀硫酸、双氧水溶解铜 |
| D.火力发电:在燃煤中加入适量生石灰 |
下列事实得出的结论错误的是
| A.维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| B.门捷列夫在前人的基础上发现了元素周期律,表明科学研究既要继承又要创新 |
| C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性 |
| D.科恩和波尔因物质结构理论方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科 |
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。下列制氢方法最节能的是
A.电解水制氢:2H2O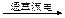 2H2↑+O2↑ 2H2↑+O2↑ |
B.高温使水分解制氢:2H2O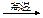 2H2↑+O2↑ 2H2↑+O2↑ |
C.太阳光催化分解水制氢:2H2O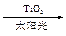 2H2↑+O2↑ 2H2↑+O2↑ |
D.天然气制氢:CH4+H2O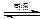 CO+3H2 CO+3H2 |