下列说法合理的是
| A.金属锂、镁在氧气中燃烧的产物分别为Li2O、MgO |
| B.H—F、H—O、H—N三个共价键的极性逐渐增强 |
| C.若X+和Y2-的核外电子层结构相同,则元素电负性X>Y |
| D.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,Z是
| A.HCl | B.FeCl2 | C.KOH | D.NaHCO3 |
利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
浓盐酸 |
MnO2 |
NaOH |
制氯气并吸收尾气 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.Y的气态简单氢化物的热稳定性比W的强 |
| B.X的最高价氧化物对应水化物的酸性比W的弱 |
| C.Y分别与Z、W形成的化合物均为碱性氧化物 |
| D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
茶叶中铁元素的检验可经过以下四步骤完成,各步骤中选用的实验用品正确且完整的是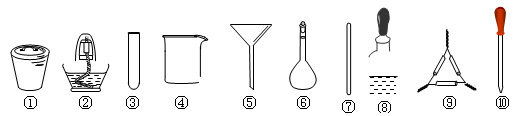
| A.将茶叶灼烧灰化,选用①、② |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到的滤液,选用④、⑤ |
| D.检验滤液中的Fe3+,选用③、⑧、⑩ |
下列离子方程式不正确的是
| A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: 2Ba2++NH4++Al3++SO42-+4OH-=Al(OH)3↓+NH3•H2O+2BaSO4↓ |
| D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |