A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
| 元素 |
A |
B |
C |
D |
E |
| 性质 或结 构信 息 |
室温下单质呈气态,原子最外层电子数与D相同 |
D3B中阳离子与阴离子的电子层结构相同 |
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 |
单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 |
E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式 。
(3)写出丙的电子式为 。并说明丙在空气中漂白的原理(用化学方程式表示) 。(请参考下表数据)
| 酸 |
电离常数 |
| HClO |
Ka=3.0×10-8 |
| H2CO3 |
Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成。它们的溶液发生如下反应:A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。
写出它们的化学式:
A:____________________,B:____________________,
C:____________________,D:____________________。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行下列实验。
| 实验步骤 |
实验现象 |
| ①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| ②取少量该溶液加热浓缩,加铜片和浓硫酸加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是________________,溶液中肯定不存在的离子是________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(说明使用试剂的名称,不必写详细操作步骤)是____________________________。
从某些植物树叶中提取的挥发油含有下列主要成分: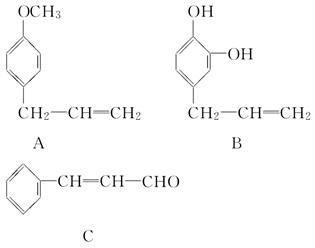
(1)写出A物质可能发生的反应类型(至少三种)__________________________。
(2)1 mol B与足量的溴水充分反应,需消耗________ mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
________________________________________________________________________。
(4)已知RCH===CHR′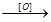 RCOOH+R′COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式:
RCOOH+R′COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式:
________________________________________________________________________。
(5)写出A与B在一定条件下,生成一种高分子化合物的化学方程式:
________________________________________________________________________。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知: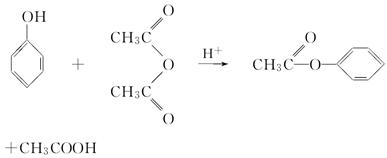
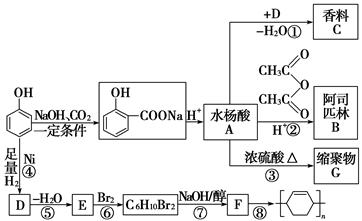
(1)写出C的结构简式:
________________________________________________________________________
________________________________________________________________________。
(2)写出反应②的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)写出G的结构简式:
________________________________________________________________________
________________________________________________________________________。
(4)写出反应⑧的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(5)写出反应类型:
④________________________________________________________________________,
⑦__________________________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是________。
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊溶液
下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏毒性,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药的合成中称为“拼合原理”的手段设计并合成出的解热镇痛药。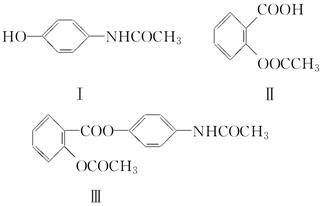
(1)为什么阿司匹林会有上述的副作用?
________________________________________________________________________。
(2)合成扑炎痛反应的反应类型为
________________________________________________________________________。
(3)扑炎痛本身并无解热镇痛效能,但口服后人体内会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,其原因是
________________________________________________________________________
________________________________________________________________________。