某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
| A.1∶2 | B.1∶4 | C.3∶4 | D.3∶2 |
某有机物在氧气里充分燃烧,生成CO2和H2O的质量比为22:9,由此可得出的正确的结论是
| A.碳、氢、氧的原子个数比为1:2:3 |
| B.碳、氢的原子个数比为1:1 |
| C.该有机物中肯定不含氧元素 |
| D.不能判断该有机物中是否含有氧元素 |
下列有机物不是同一种物质的是
A.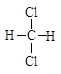 和 和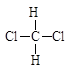 |
B.CH2=CH—CH=CH2和 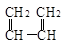 |
| C.C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 |
D.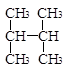 和 和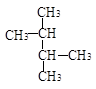 |
下列各组物质之间的化学反应,反应产物一定为纯净物的是
A.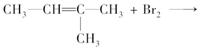 |
B.CH2===CH—CH2—CH3+HCl |
C.CH3—CH===CH2+H2O |
D.nCH2===CH2+nCH2===CH—CH3 |
按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是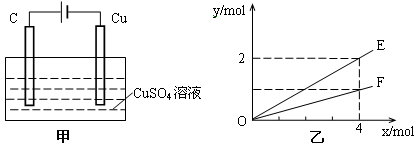
| A.E表示生成铜的物质的量 |
| B.E表示反应消耗水的物质的量 |
| C.F表示生成硫酸的物质的量 |
| D.F表示反应生成氧气的物质的量 |
下列实验不能获得成功的是
①用甲烷气体通入碘水制碘甲烷
②甲烷和溴蒸气混合光照制取纯净的一溴甲烷
③用洒精灯加热甲烷气体制取炭黑和氢气
| A.只有① | B.只有③ | C.只有② | D.①②③ |