全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g) △H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。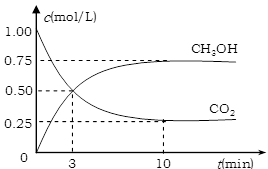
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min);
②氢气的转化率= ;
③求此温度下该反应的平衡常数K= ;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol CO2和3mol H2 |
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
①通入氧气一极的电极反应式为 ;
②随着电池不断放电,电解质溶液的pH (填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率 (填大于、小于或等于)甲烷燃烧的能量利用率。
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。 (1)W的第一电离能比氧原子的(填“大”或“小”),W的气态氢化物稳定性比
(1)W的第一电离能比氧原子的(填“大”或“小”),W的气态氢化物稳定性比 H2O(g) (填“强”或“弱”),W的单质分子中含个∏键;
H2O(g) (填“强”或“弱”),W的单质分子中含个∏键; (2)Z位于元素周期表第周期第族,Z的基态原子核外电子排布式是;
(2)Z位于元素周期表第周期第族,Z的基态原子核外电子排布式是; (3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6 )若B
)若B 是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(
是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______( 填“变深”“变浅”或“不变”)。
填“变深”“变浅”或“不变”)。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:6NOx+4x NH3 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g)ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3 (g)ΔH=-92.4 kJ·mol-1
(g)ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g)ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

图1图2
①写出该脱硝原理总反应的化学方程式:____________。
②为达到最佳脱硝效果,应采取的条件是____________。
下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物,C的焰色反应为黄色,M为红褐色固体。
(1)写出: J的结构式 ,M的化学式;
,M的化学式;
(2)基于反应①原理的化学工业称为;写出该反应的化学方程式;
(3)写出K溶液和E反应的离子方程式;写出F溶液和H反应的离子方程式;
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为
现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
⑴在右图塔式周期表相应位置标出A、B、C、D 四种元素的元素符号。同时在图中将过渡元素涂黑。
⑵用电子式表示B与C形成化合物的过程___________。
⑶图中“钾”和D形成的简单离子的半径大小为________________(用离子符号和“>”、“=”或“<”表示)。
⑷元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究方案中比较可行的是_________(填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性
⑸A元素能与另外三种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为____________。